Η μέθοδος της μικροκλίμακας είναι μια μέθοδος εκτέλεσης χημικών διεργασιών χρησιμοποιώντας πολύ μικρές ποσότητες αντιδραστηρίων (σε επίπεδο σταγόνας) και συχνά μικρά όργανα και συσκευές. Μερικά από τα μεγαλύτερα πλεονεκτήματα της μεθόδου είναι τα μειωμένα χημικά απόβλητα, η βελτιωμένη εργαστηριακή ασφάλεια,η μικρότερη έκθεση σε τοξικά χημικά, η μείωση του χρόνου εκτέλεσης πειραμάτων (λιγότερο ή καθόλου πλύσιμο οργάνων), η αισθητή μείωση του εργαστηριακού κόστους κ.α.
Παραδείγματα εργαστηριακών ασκήσεων χημείας σε μικροκλίμακα
Ακολουθούν μερικές προτάσεις υλοποίησης απλών και πιο σύνθετων εργαστηριακών ασκήσεων με τη μέθοδο της μικροκλίμακας.
Σε αυτόν τον σύνδεσμο μπορείτε να βρείτε τα φύλλα εργασίας που αξιοποιήθηκαν στο πλαίσιο επιμόρφωσης σε επεξεργάσιμη και εκτυπώσιμη μορφή.
Α. Το χρώμα μερικών από τους πιο συνηθισμένους δείκτες σε όξινα και βασικά διαλύματα:
Κατά την υλοποίηση του πειράματος μελετήθηκε η μεταβολή του χρώματος μερικών από τους πιο συνηθισμένους δείκτες των σχολικών εργαστηρίων (κόκκινο λάχανο, βάμμα του ηλιοτροπίου, ηλιανθίνη και φαινολοφθαλεϊνη) σε περιβάλλον όξινων διαλυμάτων (υδροχλωρικό οξύ, κιτρικό οξύ και οξικό οξύ) και βασικών διαλυμάτων (ajax, ασβεστόνερο, υδροξείδιο του νατρίου).
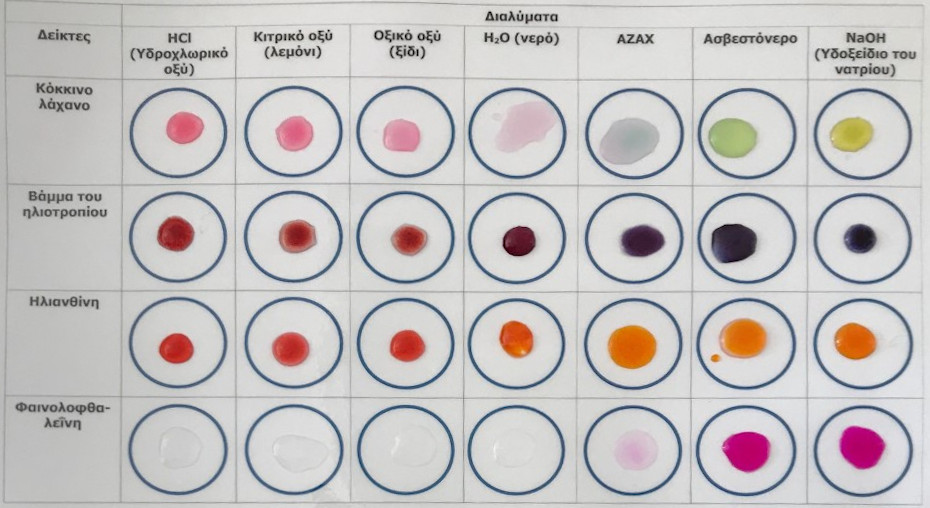
Εικόνα 1. Δείκτες σε όξινο και βασικό περιβάλλον
Β. Μελέτη διαλυτότητας ουσιών σε διαφορετικό είδος διαλύτη
Σκοπός του πειράματος είναι η μελέτη της εξάρτησης της διαλυτότητας διαφόρων ουσιών (αλάτι, στερεός CuSO4, άμμος, λάδι, μελάνι) από το είδος του διαλύτη (νερό, αιθανόλη).
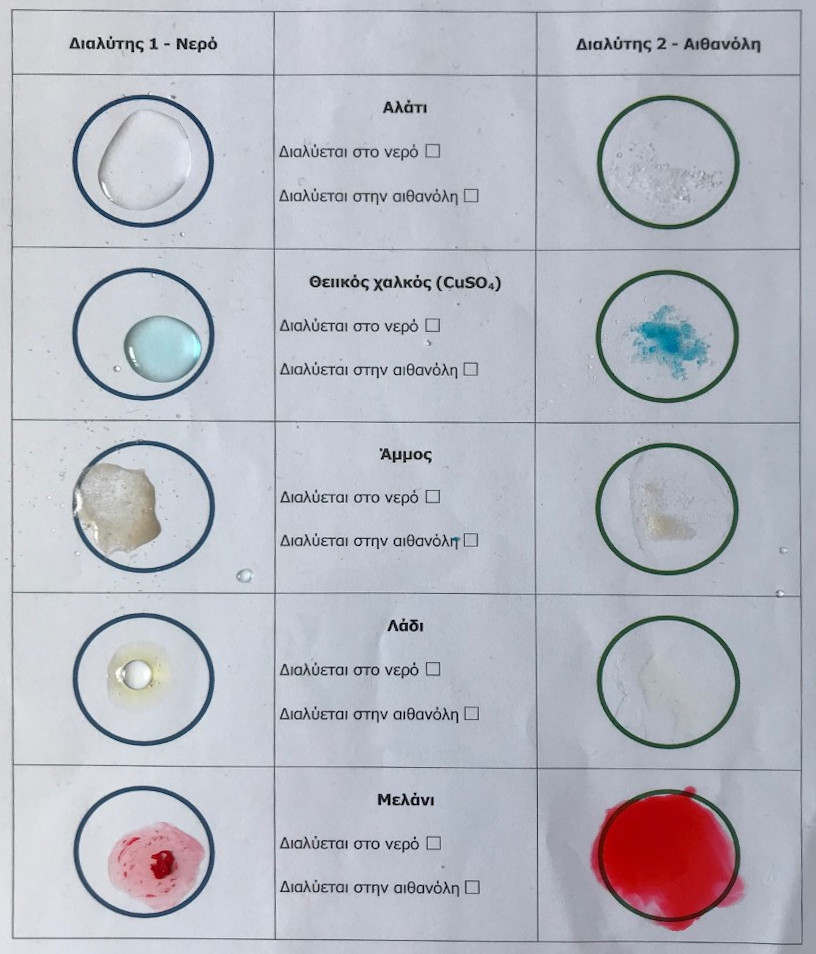
Εικόνα 2. Διαλυτότητα ουσιών σε νερό και αιθανόλη
Γ. Αντιδράσεις απλής αντικατάστασης
Κατά την επίδειξη αντιδράσεων απλής αντικατάστασης αξιοποιήθηκαν παραδείγματα αντιδράσεων μετάλλων που αντικαθιστούν λιγότερα δραστικά μέταλλα στις ενώσεις τους:
α. Cu + AgNO3 → Cu(NO3)2 + Ag
β. Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
γ. Zn + CuSO4 → ZnSO4 + Cu
ή αντιδράσεις αντικατάστασης του υδρογόνου των οξέων από ένα μέταλλο:
δ. Fe + HCl → FeCl2 + H2
ε. Al + HCl → AlCl3 + H2
στ. Cu + HCl → X
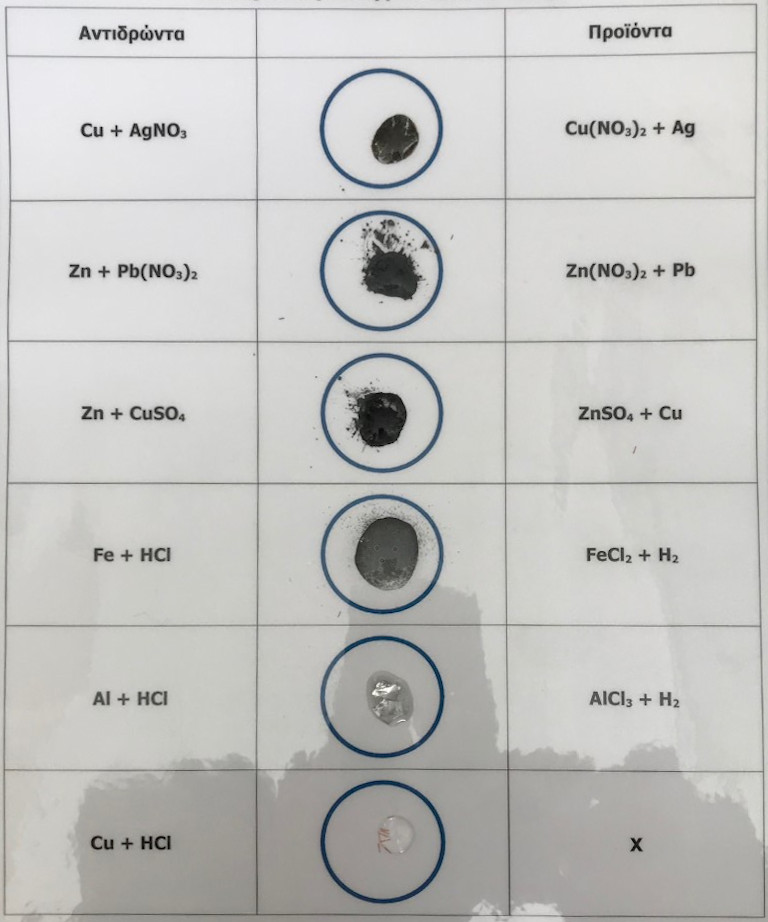
Εικόνα 3. Αντιδράσεις απλής αντικατάστασης
Δ. Αντιδράσεις διπλής αντικατάστασης
Μελετήθηκαν παραδείγματα αντιδράσεων διπλής αντικατάστασης με αποτελέσματα την καταβύθιση ιζήματος ή τον σχηματισμό αερίου:
1. Pb(NO3)2 + KI → PbI2 + KNO3
2. Na2S + AgNO3 → Ag2S + NaNO3
3. CuSO4 + NaOH → Cu(OH)2 + Na2SO4
4. Ba(NO3)2 + Na2SO4 → BaSO4+ NaNO3
5. AgNO3 + K2CrO4 → Ag2CrO4 + KNO3
6. HCl + CaCO3 → CaCl2 + CO2 + H2O
7. NaCl + KBr → X
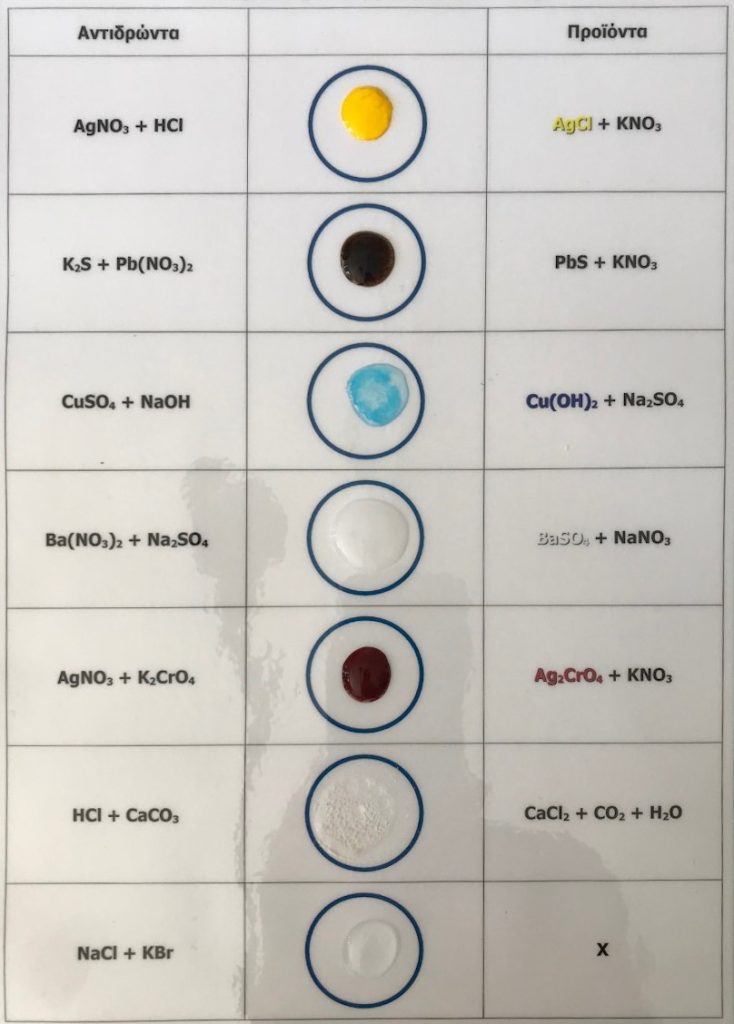
Εικόνα 4. Αντιδράσεις διπλής αντικατάστασης
E. Αγωγιμότητα ουσιών
Για τον έλεγχο της αγωγιμότητας διαλυμάτων ή και στερεών ουσιών αξιοποιήθηκε αυτοσχέδιο αγωγιμόμετρο. Οδηγίες για την κατασκευή του οργάνου μέτρησης μπορείτε να βρείτε εδώ.
Σκοπός του πειράματος είναι ο έλεγχος διέλευσης ή μη ηλεκτρικού ρεύματος μέσα από στερεές ουσίες (αλάτι, λάστιχο, χαλκός, γραφίτης) και διαλύματα (διάλυμα ζαχαρόνερου, νερό βρύσης, διάλυμα αλατόνερου). Την εκτέλεση του πειράματος μπορείτε να τη δείτε στο παρακάτω βίντεο:
Επιπλέον το αγωγιμόμετρο χρησιμοποιήθηκε για την επίδειξη της εξάρτησης της αγωγιμότητας (μεταβολή φωτεινότητας LED) από τη συγκέντρωση του διαλύματος και από το είδος του διαλύτη (ισχυρό – ασθενές οξύ):
Στ. Η Χημεία του Σιδήρου
Μέσω μιας σειράς αντιδράσεων επιδεικνύονται πολλές από τις ιδιότητες των ενώσεων του σιδήρου, όπως η πραγματοποίηση αντιδράσεων διπλής – απλής αντικατάστασης αλλά και σύνθετων οξειδοαναγωγικών, καθώς και ο σχηματισμός σύμπλοκων ενώσεων του σιδήρου.
Οι χημικές μεταβολές που ερευνώνται περιγράφονται συνοπτικά παρακάτω:
- Αντίδραση απλής αντικατάστασης και παραγωγή μεταλλικού ιόντος σιδήρου που έλκεται από μαγνήτη:Mg + FeSO4 → MgSO4 + Fe
- Σχηματισμός πράσινου ιζήματος του δισθενούς σιδήρου (Fe2+)FeSO4 + 2NaOH → Na2SO4 + Fe(OH)2
- Το διάλυμα χρωματίζεται καφέ καθώς ο δισθενής σίδηρος (Fe2+) οξειδώνεται σε τρισθενή (Fe3+). Παράλληλα εμφανίζονται φυσαλίδες, καθώς η περίσσεια του υπεροξειδίου του υδρογόνου διασπάται σε οξυγόνο:2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O
- Σχηματισμός καφέ ιζήματος Fe(OH)3Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3
- Προσωρινός σχηματισμός του σύμπλοκου Fe(S2O3)2 (βαθύ μωβ χρώμα) που διασπάται άμεσα με αναγωγή του τρισθενούς σιδήρου σε δισθενή (Fe2+):Fe(S2O3)2 + Fe3+ → 2Fe2+ + S4O62–
- Παραγωγή πράσινου ιζήματος του δισθενούς σιδήρου:Fe2+ + 2NaOH → 2Na+ + Fe(OH)2
- Σχηματισμός σύμπλοκου γνωστού ως Turnbull’s Blue με χαρακτηριστικό μπλε χρώμα και χημικό τύπο όμοιο με αυτόν στην επόμενη αναντίδραση.
- Σχηματισμός σύμπλοκου γνωστού ως Prussian Blue με χαρακτηριστικό μπλε χρώμα:K+ + Fe3+ + [Fe(CN)6]4– → KFe[Fe(CN)6]
- Σχηματισμός ενός βαθυκόκκινου σύμπλοκου σύμφωνα με την αντίδραση:
- Fe3+ + CNS– → 2Na+ + [Fe(CNS)]2+

Εικόνα 5. Η χημεία του σιδήρου
Ζ. Αντιδράσεις αέριας αμμωνίας σε τρυβλίο Petri
Μια σειρά διαλυμάτων τοποθετούνται περιφερειακά σε τρυβλίο petri. Η αμμωνία που παράγεται στο κεντρικό αντιδραστήριο του τρυβλίου διαχέεται και διαλύεται στο νερό δημιουργώντας ιζήματα. Η παρουσία των σχηματιζόμενων ενώσεων πιστοποιείται από τη χρωματική μεταβολή των αρχικών διαλυμάτων. Ενδεικτικά, αξιοποιήθηκαν τα παρακάτω διαλύματα:
1. HCl 0,01M με δύο σταγόνες δείκτη μπλε της θυμόλης
2. CuSO4 0,1Μ
3. NiSO4 0,1M
4. CoCl2 0,1M
5. Fe(NO3)3 0,1M
6. FeSO4 0,1
7. ZnSO4 0,1M
8. Pb(NO3)2 0,1M
9. BaCl2 0,1M
10. MnSO4 0,1M
11. MgSO4 0,1M
Στο κεντρικό αντιδραστήριο τοποθετήθηκαν μερικοί κόκκοι στερεού ΝΗ4Cl και προστέθηκε πυκνό διάλυμα ΝαΟΗ.

Εικόνα 6. Αλληλεπίδραση αμμωνίας με διάφορα διαλύματα. Εικόνα του τρυβλίου πριν (Α) και μετά (Β) την προσθήκη ΝαΟΗ σε ΝΗ4Cl.
Η. Μείγματα – Χημικές ενώσεις
Εργαστηριακή άσκηση με σκοπό τη διαπίστωση της διάκρισης ενός μείγματος χημικών στοιχείων από την αντίστοιχη χημική ένωση που τα περιέχει.
Αρχικά ένας ασθενής μαγνήτης αξιοποιείται αρχικά για την επίδειξη φυσικών ιδιοτήτων μείγματος θείου (S) – σιδήρου (Fe) και ένωσης θειούχου σίδηρου (FeS – εικόνα 7Α).
Ο έλεγχος των χημικών ιδιοτήτων πραγματοποιείται σε δύο τρυβλία petri, ένα από τα οποία περιέχει το μείγμα και το άλλο την ένωση (εικόνα 7Β). Στα τρυβλία έχει ήδη τοποθετηθεί από μία σταγόνα των παρακάτω διαλυμάτων:
Pb(NO3)2 0,1M
ZnSO4 0,1Μ
KΜnO4 0,002Μ
και στη συνέχεια, πάνω στο μίγμα ή την ένωση προστίθεται διάλυμα υδροχλωρικού οξέος. Στο τρυβλίο της ένωσης (εικόνα 7Δ) παρατηρούμε σχηματισμό ιζήματος PbS και αποχρωματισμό του διαλύματος KΜnO4.

Εικόνα 7. Διάκριση μείγματος-χημικής ένωσης
Θ. Διάχυση σε μικροκλίμακα
Η εργαστηριακή δραστηριότητα της διάχυσης σε μικροκλίμακα αποσκοπεί στην επίδειξη του σχηματισμού ιζήματος καθώς και αερίου κατά τη διάρκεια χημικών μεταβολών σε επίπεδο σταγόνας. Τα αντιδραστήρια (σε στερεή φυσική κατάσταση) ενσωματώνονται εκατέρωθεν σε σταγόνα που περιέχει απιονισμένο νερό (εικόνα 8Α), τα σωματίδια διαχέονται μέσω του νερού και τελικά συναντώνται προκειμένου να σχηματίσουν ίζημα ή αέριο. Το ίζημα εμφανίζεται με τη μορφή έγχρωμης γραμμής στο εσωτερικό της σταγόνας και το αέριο με τη μορφή φυσαλίδων.
Τα στερεά αντιδραστήρια που αξιοποιήθηκαν στο πλαίσιο αυτής της εργαστηριακής άσκησης είναι τα παρακάτω:
BaCl2.2H2O και Na2CO3 (διάχυση και σχηματισμός λευκού ιζήματος με τη μορφή γραμμής – εικόνα 8Β).
Na2CO3 και C2H2O4 ( διάχυση και σχηματισμός αερίου με τη μορφή φυσαλίδων – εικόνα 8Γ).
Pb(NO3)2 και KI (διάχυση και σχηματισμός κίτρινου ιζήματος με τη μορφή γραμμής – εικόνα 8Δ).
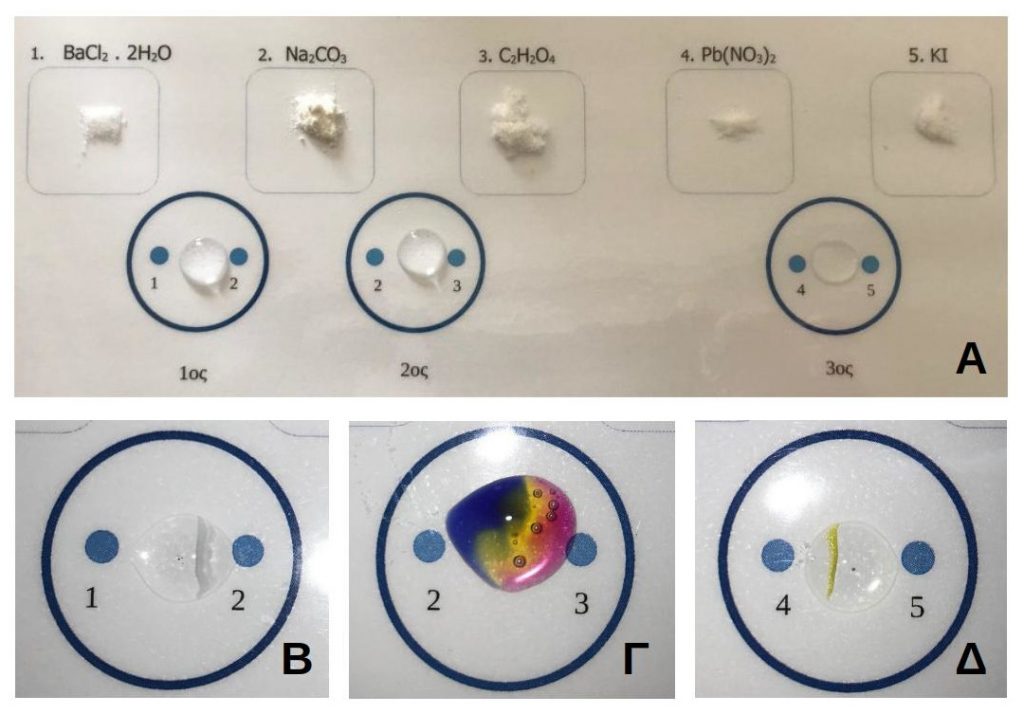
Εικόνα 8. Διάχυση σε μικροκλίμακα
Ι. Επίδειξη ηλεκτρόλυσης σε μικροκλίμακα
Η επίδειξη του φαινομένου τη ηλεκτρόλυσης του νερού υλοποιήθηκε σε δύο εργαστηριακά πειράματα. Στην πρώτη εργαστηριακή άσκηση προτείνεται η κατασκευή αυτοσχέδιας συσκευής επίδειξης ηλεκτρόλυσης Hoffman (εικόνα 9).

Εικόνα 9. Αυτοσχέδια συσκευή Hoffman
Στο δεύτερο μέρος, η ηλεκτρόλυση πραγματοποιείται σε επίπεδο σταγόνας παρουσία δείκτη και μαγνητικού πεδίου. Η σταγόνα διαχωρίζεται χρωματικά σε όξινη και βασική περιοχή (όπως πιστοποιείται παρουσία δείκτη), καθώς τα ιόντα εξαναγκάζονται σε περιστροφή από το μαγνητικό πεδίο.

